放疗与化疗是肝癌治疗的常用手段,两者联合使用能够产生极好的协同治疗作用,因此,开发合理的放化疗结合策略,具有极大的临床意义。目前,临床上对癌症患者主要采取放疗配合小剂量的化疗药物,或是放疗与化疗交替进行这两种模式。这些综合治疗方法虽能起到一定的肿瘤抑制作用。但是,却无法有效地控制高度恶性的肝癌患者病情的发展。这是因为癌组织独特的微环境造成了肿瘤对放射线的不敏感以及对化疗药物的多药耐药。此外,放疗与化疗对正常组织的无选择性杀伤,给患者带来了严重的毒副反应。因此,急需开发更为高效安全的放化疗综合治疗手段。一方面,需要同时提高放疗与化疗的靶向性,实现对肝癌部位精准剂量的化疗药物递送和放疗增敏。另一方面,为了最大程度地发挥放化疗的协同作用,肝癌的放疗与化疗应在时空上具有一致性。基于上述目标,需要开发一种肝癌靶向性强的多功能药物载体用以运输化疗药物与放疗增敏剂,该载体应既能将化疗药物与放疗增敏剂同时导入肝癌细胞,又能使两者之间的运输互不影响,并且具有一定的药物示踪能力,可以用于指导物理师进行合理的放射线照射。
近日,苏州医工所董文飞研究员课题组开发了一种非对称结构的Janus型金棒-介孔二氧化硅纳米载药系统。该纳米载药系统由一端的金纳米棒和另一端的介孔二氧化硅棒组成。金纳米棒功能元件因其高的原子序数和大的比表面积而具有极好的光电效应,是理想的放疗增敏剂。而功能化的二氧化硅介孔棒可以实现精准剂量的化疗药物担载和肿瘤组织响应型的药物释放,进而降低了化疗药物对正常细胞的影响。此外,金棒纳米材料相比于碘等临床上常用的CT成像造影剂,具有更好的X射线吸收系数。因此,通过结合CT成像技术,可以更清晰地对该载体在体内运输情况的进行实时监控。由于大部分肝癌细胞膜表面叶酸受体高表达,科研人员在该纳米载药系统的表面偶联了叶酸多聚物,以增强其肝癌组织的靶向性和在体内环境的稳定性。并通过一系列实验,在细胞水平和动物水平上证明了该纳米载药系统对肝癌具有极好的放化疗协同治疗作用和较高的生物安全性。科研人员也对Janus型金棒-介孔二氧化硅纳米载药系统与传统的核壳型的金棒-介孔二氧化硅纳米载药系统进行了系统地比较。发现了Janus型结构在载药能力,CT成像以及放化疗协同作用上,具有明显的优势。因此,Janus型金棒-介孔二氧化硅纳米载药系统有希望成为新的肝癌放化疗综合治疗剂。相关工作已发表在了ACS Nano 11, 12, 12732-12741上,(SCI, IF= 13.709)https://pubs.acs.org/doi/10.1021/acsnano.7b07486。

图1为Janus型金棒-介孔二氧化硅纳米载药系统在肝癌的放疗增敏,化疗药物的响应性释放,放化疗的协同治疗以及CT成像上的应用。

图2为Janus型金棒-介孔二氧化硅纳米载药系统的合成与表征。(A)透射电镜照片。(B)红外光谱吸收。(C)紫外-可见-近红外光吸收,(D)氮气脱附吸附曲线。(E)粒径分布和胶体分散系数。(F)在水中储存7天后的粒径分布和胶体分散系数。结果表明,Janus型金棒-介孔二氧化硅纳米载药系统具有均一的形貌,极好的分散性,优异的的介孔性质和较好的稳定性。

图3为Janus型金棒-介孔二氧化硅纳米载药系统的放化疗协同抗肿瘤作用和生物安全性(A)肿瘤照片,(B)肿瘤重量,(C)肿瘤生长曲线,(D)裸小鼠体重变化,(E)肝脾肾的重量指数,(F)肌酸激酶的变化。这些结果表明Janus型金棒-介孔二氧化硅纳米载药系统具有极好的放化疗协同抗肿瘤作用和生物安全性。
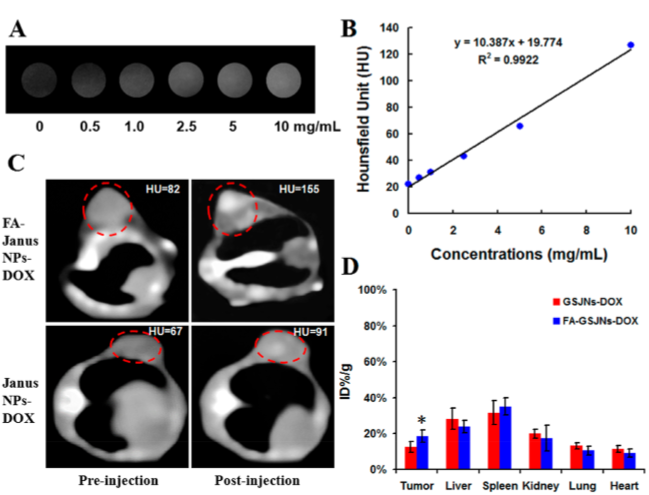
图4为CT成像与生物分布。(A)不同浓度的FA-GSJNs-DOX的CT成像效果;(B)不同浓度的FA-GSJNs-DOX的CT值;(C)裸小鼠的CT成像;(D)纳米载体在重要器官的生物分布。这些结果表明Janus型金棒-介孔二氧化硅纳米载药系统具有极好的CT成像造影功能。
 附件下载:
附件下载: