出品:科普中国
制作:中国科学院苏州生物医学工程技术研究所
监制:中国科学院计算机网络信息中心
引言:2014年的诺贝尔化学奖颁给了三位科学家:Eric Betzig、Stefan W. Hell和William E. Moerner,以表彰他们在超分辨荧光显微镜领域做出的贡献。超分辨荧光显微技术在生命科学领域具有重要意义,但超分辨有什么优点,起到什么作用,怎样实现超分辨?这些问题,让我们来为大家一一解答。

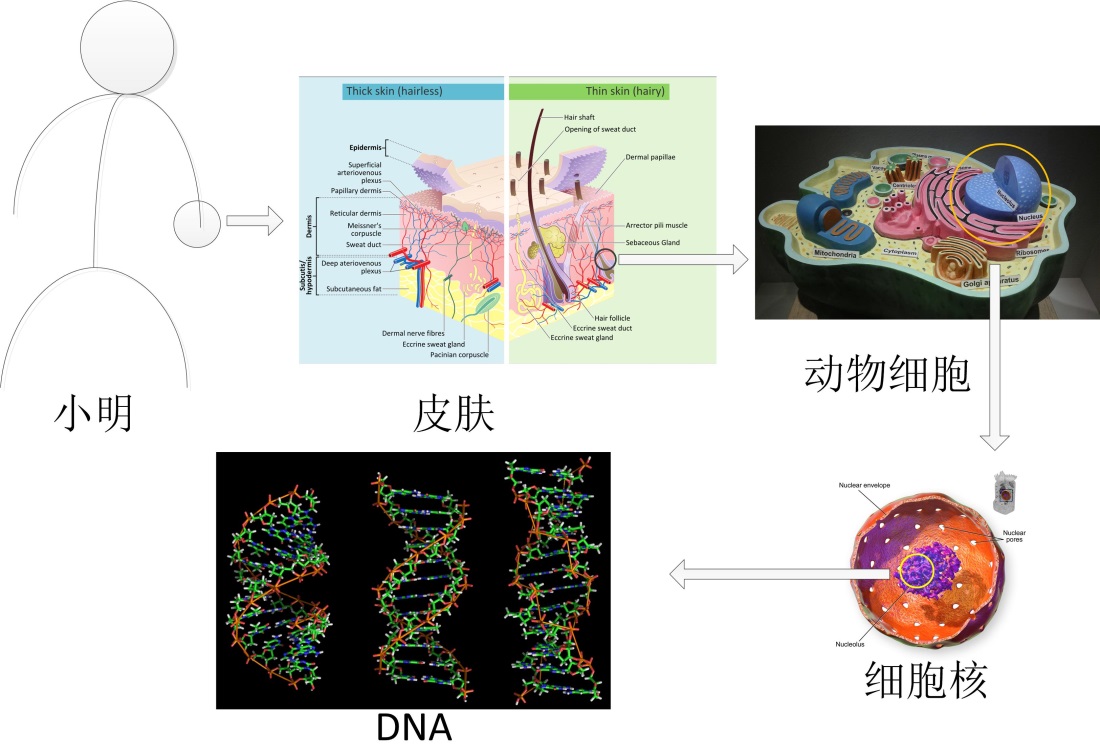
每个生物个体都是一个复杂的系统,以身高170厘米的小明为例,他的手部表面覆盖着皮肤(组织),皮肤由细胞组成,细胞内含有细胞核(细胞器),细胞核的核仁里含有遗传物质DNA(分子),分子是化学过程和生命过程的最小单元。生命科学从微观层面观察生命过程,大到组织和细胞,小到蛋白质、DNA、RNA等化学物质,通过研究它们在生命过程中的变化,揭示生命的物质基础和基本现象。从尺度上来说,组成小明身体的细胞平均尺寸大约几十微米,而最大的分子——蛋白质的尺寸只有几十纳米,相当于他身高的1/107。
孔子告诉我们,工欲善其事,必先利其器。细胞和分子这么小,想要看到它们,需要显微成像技术的帮助。
顾名思义,显微成像是一种观察微小物体的手段。原子力探针和光学探针是两种常用的显微技术,前者就像盲人摸象,利用一个微小的探针接近样品,通过反馈的作用力来实现观测,这种触摸的方式只能探测样品表面,还会对脆弱的样品造成损伤,不适用于观察生命过程;相比之下,光学探针显微就像隔岸观火,把探测用的光束打到物体上,通过收集透射或者反射光的方式来进行观测,对样品的影响很小。

为了提高光学显微的成像效果,以便从复杂的细胞组织中提取出自己想要的细节,科学家还采用了荧光标记的方法,在细胞中加入特殊的荧光标记物,这些标记物在特定的光照下,有的发出红光,有的发出绿光,而且每种荧光标记物都具有一定的选择性,只与细胞中既有的特定分子结合,然后发出荧光。荧光成像大大提高了光学显微成像的对比度,还帮助科学家分辨细胞中的不同结构。图中所示是牛肺动脉内皮细胞,细胞核呈现蓝色,线粒体呈现红色,微丝呈现绿色。然而光学显微也有自己的缺陷——就像用望远镜看天上的星星,即使再先进的、口径再大的望远镜,也没法看清所有星星;显微成像的分辨能力也受到光学成像系统的限制,这种限制来自于光的衍射,因此被称作衍射极限。

波动性是光的基本特性之一,由此产生的衍射效应始终困扰着包括显微、望远在内的光学成像系统。德国物理学家Ernst Abbe发现了显微镜的衍射极限,并将公式刻在自己的墓碑上。这里我们不去详细分析衍射极限的成因,只需要大家知道这样一个结论:由于衍射极限的存在,显微成像系统的照明光只能在样品上形成有限小的圆形光斑,被称作艾里斑;同样地,样品上的分子只能在成像相机上形成有限小的圆斑。从成像的角度来说,衍射极限影响下的显微成像系统只能分辨有限小的细节,一般在200纳米到300纳米之间。
前面已经说过,细胞的直径大约几十微米,想要研究细胞内的生命过程,至少要能看清细胞器才行。传统光学显微镜的分辨率用来看细胞还马马虎虎,对细胞器就只能看个大概,没法满足生命科学研究的需求。近年来,科学家们从不同的角度入手,实现突破衍射极限的光学显微成像,也就是文章开头提到的超分辨荧光显微镜。超分辨的实现途径很多,有结构光照明(SIM)、受激发射损耗(STED)、光激活定位显微(PALM)、随机光学重构(STORM)等,限于篇幅我们只讲获得诺贝尔奖的两种——Stefan W. Hell的受激发射损耗(STED)和Eric Betzig、William E. Moerner的光激活定位显微技术(PALM)。

传统光学显微镜采用宽场成像的方式,照明光一次照亮整个成像范围,然后用相机对整个成像范围进行曝光成像,一次获得整幅图像。“管中窥豹”型的扫描成像则有所不同,照明光聚焦在样品上,形成一个极小的光点——也就是所谓的“管”,每次只对光点对应的区域进行成像;当我们改变光点的位置,使它依次扫遍整个样品,也就获得了一幅完整的图像。有人要问了,即使采用“管中窥豹”的方式,每次聚焦的光点依然受到衍射极限限制,系统分辨能力比起所谓的宽场成像没有提高,扫描过程又增加了系统的复杂度,不是自找麻烦吗?Stefan W. Hell的回答很简单:只要设法缩小“管中窥豹”的“管”,就能提高系统的分辨能力,实现超分辨。
通常的荧光成像是这样的:荧光分子在吸收了照明光(或者叫激发光)A之后,会在很短的时间持续发出荧光B。扫描成像系统的分辨能力取决于A在样品处的聚焦光点大小。Hell找到了荧光的开关——第三种光C,在C的照射下,荧光分子即使吸收了激发光A,也没法再发出荧光B。Hell让开关C同样打在样品上,形成一个四周亮、中心暗的“面包圈”,“面包圈”中心的暗区域比艾里斑还要小;然后把面包圈套在艾里斑上,就像在“管”的出口又加了一个小孔,使“管”的直径大大减少,也就提高了整台显微镜的分辨能力。

荧光分子是荧光样品的最小发光单元,由于衍射极限的限制,在相邻的两个荧光分子同时点亮时,我们只能看到一个光斑,但如果每次只点亮一个分子,就可以通过光斑,计算得到荧光分子的准确位置。
Eric Betzig和William E. Moerner采用的就是这样一种方法,如果说STED技术核心是“擦除”,那么PALM技术的核心就是“定位”:Moerner发现存在光D可以“打开”荧光。通过控制D的照射剂量,保证每次只有少量荧光分子处在打开状态;当荧光分子在开与关之间切换时,整幅图像中的荧光信号就会像银河中的星星一样亮暗闪烁,只要进行足够多次的开关和成像,就可以组合出整个样品的图像。

作为光学发展史上的重大进步,衍射极限的突破显然是一个物理学问题,三位科学家以化学方法为工具,突破衍射极限并摘走了2014年诺贝尔化学奖,由此受益最大的则是生物学。更有趣的是,三位诺贝尔奖得主都是物理学出身,因此超分辨显微成像技术可以称得上是交叉学科的重大胜利。
随着超分辨技术的发展与成熟,国际上主流研究方向已经由系统本身转向应用,几大显微公司也纷纷推出各自的商业化产品,但空间与时间、成本与性能的博弈还在持续,在可以预见的将来,超分辨显微成像技术仍有进步的余地。
(来源:科普中国 http://tech.qq.com/a/20151223/021306.htm )
 附件下载:
附件下载: