宫颈癌是一种常见的致死性疾病,每年有大约500000人被确诊为宫颈癌,而平均死于宫颈癌的患者每年竟高达近300000人。放疗是一种治疗宫颈癌的重要手段,尤其是针对那些宫颈癌早期的患者以及那些不适合手术的人群。然而,传统的放疗治疗效果有限,并且存在着严重的毒副作用。这是由于当射线照射肿瘤部位时,只有一小部分射线被肿瘤组织吸收,而大部分射线通过了正常组织而引起了系统毒性。因此,提高肿瘤组织对放疗的敏感性,开发肿瘤组织靶向的放射治疗,并协同其他安全有效的治疗模式是提高宫颈癌治疗效果并降低毒副作用的关键。光热治疗,作为一种由近红外光介导的物理治疗,可以通过产生局部高温而杀死肿瘤细胞而不引起正常组织的损失。有研究表明,高温可以增加肿瘤组织对放疗的敏感性。因此,放疗结合光热治疗是一种极具吸引力治疗手段。然后,寻找一种合适的药剂既能同时驾驭两种治疗模式又能提高放疗的靶向性并增加放疗的敏感性依旧是一个难题。
最近,苏州医工所检验室董文飞研究员课题组与苏州市立医院物理师胡睿根据临床实际情况,构建了一种核壳型的磁金纳米平台。利用金纳米材料的表面等离子共振效应以及光电效应,实现了对宫颈癌的光热治疗与放疗增敏。并利用四氧化三铁核心的高磁响应性能,通过外加磁场,提高了该纳米粒子对肿瘤细胞的靶向性。董文飞课题组通过该纳米粒子开发了高效安全的宫颈癌治疗模式。
实验表明,该磁金纳米颗粒具有均一的球形形貌,极强的磁性,极好的生物相容性以及高效的光热转化能力。在细胞实验中,低浓度的纳米颗粒在短时间的近红外光照射下就可以导致大量的宫颈癌细胞死亡。当结合放疗后,该纳米粒子展现了协同的抗肿瘤效果。同时,外加磁场进一步增强了这种协同治疗对宫颈癌细胞的抑制。因此,我们可以得出结论:磁金纳米颗粒在宫颈癌的靶向协同治疗上,具有极好的临床转化前景。相关工作已发表在Nanomaterials(Nanomaterials 2017, 7(5), 111; doi:10.3390/nano7050111)上。
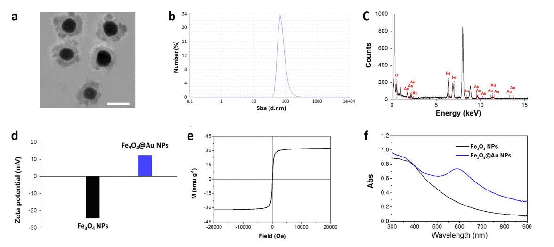
图1为磁金纳米粒子的形貌性质的表征a)透射电镜b)动态光衍射c)能量分别d)电势能 e)磁性分析f)近红外光吸收。如图所示,该纳米粒子展现了均一的形貌,稳定的理化性质以及强的近红外吸收的特点。
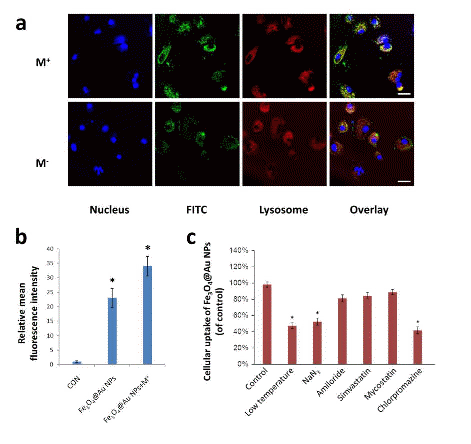
图2为磁金纳米粒子的内吞机制a) 共聚焦分析溶酶体与纳米粒子的共定位b)流式细胞仪定量分析荧光强度c)细胞内吞抑制分析。由此可见,该纳米粒子可以通过溶酶体进入细胞,并且网格蛋白介导的内吞为该纳米粒子主要的内吞途径。
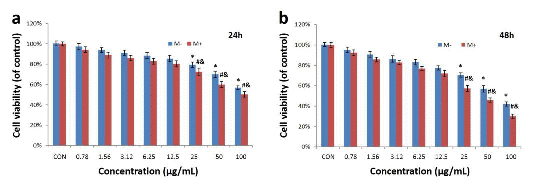
图3为磁金纳米粒子的细胞毒性分析。a) 24h b) 48h。由此可见,该纳米粒子的毒性呈剂量时间依赖型,12.5μg/mL 为安全的剂量。

图4为磁金纳米粒子的光热治疗效果分析。a) 近红外光诱导纳米粒子的升温情况 b)不同时间的近红外光辐射抑制肿瘤细胞效果。由此可见,该纳米粒子具有极高的光热转化效率和极好的抗肿瘤效果。
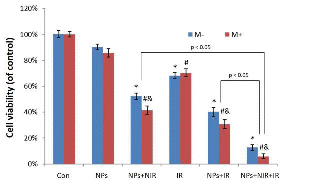
图5为磁金纳米粒子协同治疗的效果。如图所示,通过磁金纳米粒子的增加了宫颈癌细胞对放疗的敏感性,提高了放疗的效果。相比于单纯放疗组和单纯光热治疗组,协同治疗组展现了更强的抗肿瘤效果。而外加磁场进一步提升了该纳米粒子协同治疗的疗效。
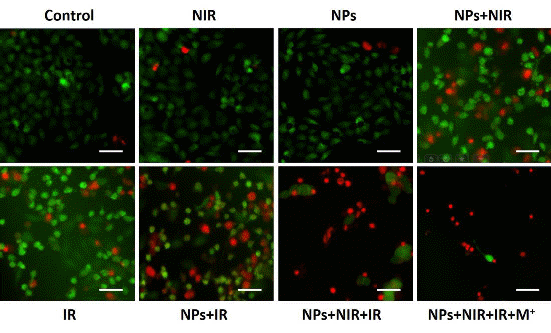
图6为活死细胞染色对比不同组的细胞杀伤情况。在协同治疗组中,死亡的肿瘤细胞最多。
 附件下载:
附件下载: