感染是导致人类死亡的主要原因之一,全世界每年约有1700万受害者。全世界范围内对抗生素的滥用导致许多病原菌对抗生素产生了空前的耐药性,“超级细菌”的出现和广泛流行使感染性疾病的治疗再次成为世界性难题。尽管科学家仍在开发新的抗生素,但开发速度远远落后于病原菌耐药发展的速度。因此,迫切需要新的抗菌剂或治疗策略来对抗这些高度耐药的细菌。
光热治疗(photothermal therapy,PTT)是一种基于光化学反应的微创技术,通过将光能转化成热能,从而杀死细菌。其物理特性的治疗机制使它在治疗细菌感染时可以避免耐药性的产生。PTT的核心是强光转化效率纳米材料的开发。光热纳米材料的研发是领域内被广泛关注的热点,材料涉及到贵金属、半导体、碳纳米材料和有机化合物等,它们均表现出非常好的光热效果与杀菌效果。但是由于这些材料对细菌缺乏特异性,对它们的利用只能停留在体外阶段,因为光热效果在杀菌的同时很容易对宿主细胞造成伤害。因此,研发一种具有特异性的光热杀菌材料格外重要。
MurD连接酶是细菌细胞壁合成中非常重要的酶,主要作用是催化中间产物与D-谷氨酸(D-Glu)结合。由于该酶只存在于原核生物中,并且也只有原核生物能够利用D型的氨基酸,所以D-Glu衍生物常被用于研发抗菌剂,可以通过抑制细胞壁合成达到抗菌的目的。
近日,中科院苏州生物医学工程技术研究所宋一之课题组和董文飞课题组以此为靶点,共同设计并开发了一种新型细菌特异性结合的纳米抗菌碳点BAPTCDs (Bacteria-Affinitive Photothermal Carbon Dots)。设计原理如图1所示,BAPTCDs由邻苯二胺和D-Glu通过溶剂热的方法合成,可以特异性结合细菌,并在激光照射下迅速升温,破坏细菌细胞壁,杀死细菌。

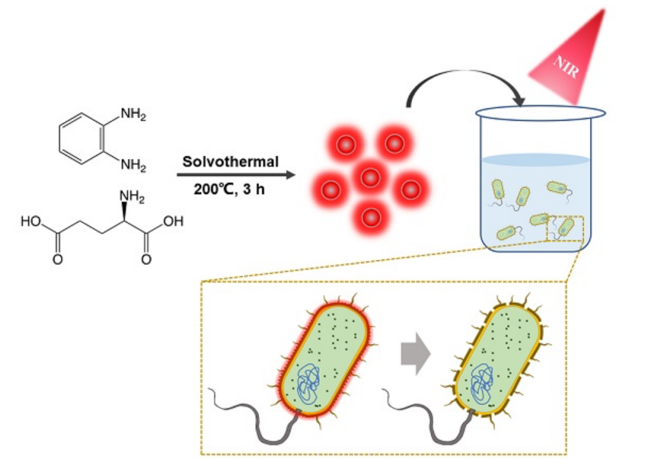
图1 BAPTCDs合成和作用机理示意图
BAPTCDs具有非常好的光热效果,如图2所示,它可以在808 nm激光照射下迅速升温,并在10分钟内达到稳定。BAPTCDs的升温效果会随着材料浓度和激光功率的升高而升高,因此后期使用可以通过材料浓度和激光功率灵活调节升温效果。
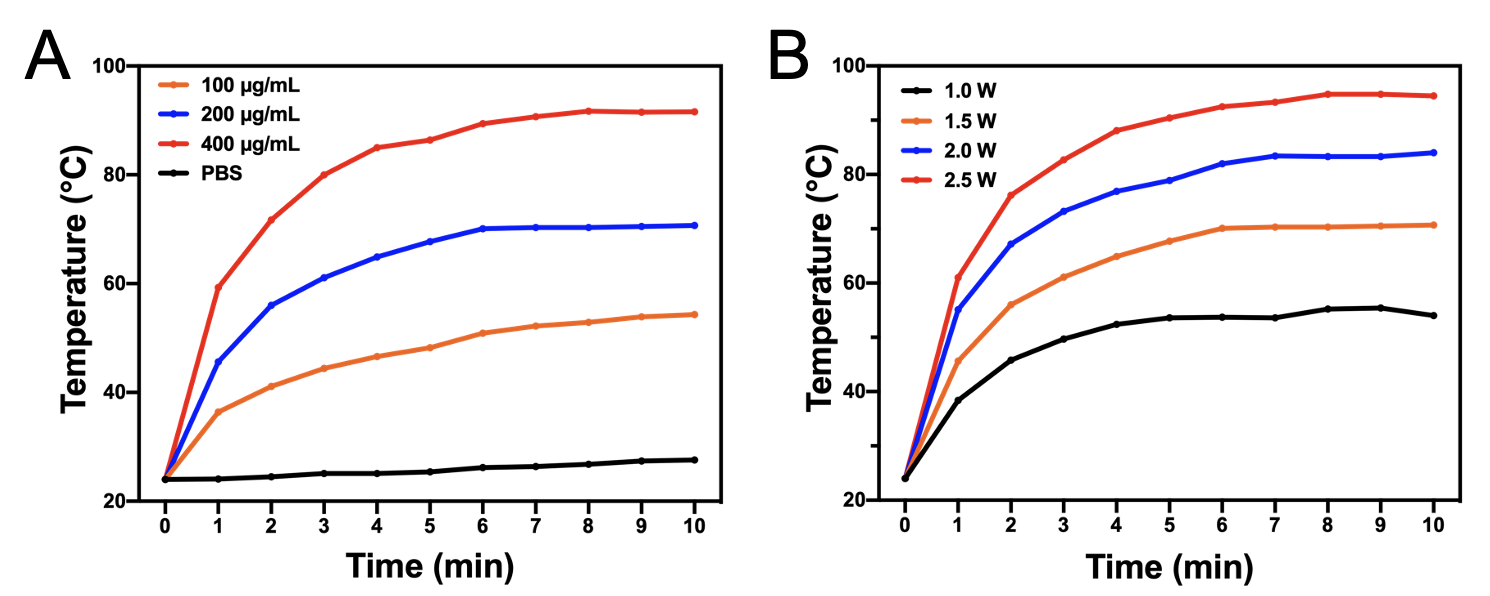
图2 BAPTCDs光热效果图(图A为不同浓度BAPTCDs在808 nm激光器1.5 W/cm2功率照射下的升温情况,图B为200 μg/ml BAPTCDs溶液在不同激光功率下的温度变化情况)
如图3所示,BAPTCDs的D型结构使它本身可以通过侵入细菌细胞壁杀死细菌,达到80以上的杀菌效率。结合激光器照射产生的高温,可以杀死96.33%的大肠杆菌(ATCC 700926)和接近100%的金黄色葡萄球菌(ATCC 29213)。结合碳点材料本身具有的高稳定性高、荧光量子效率高、水溶性好和无毒等优点,使得该材料具有非常好的应用前景。
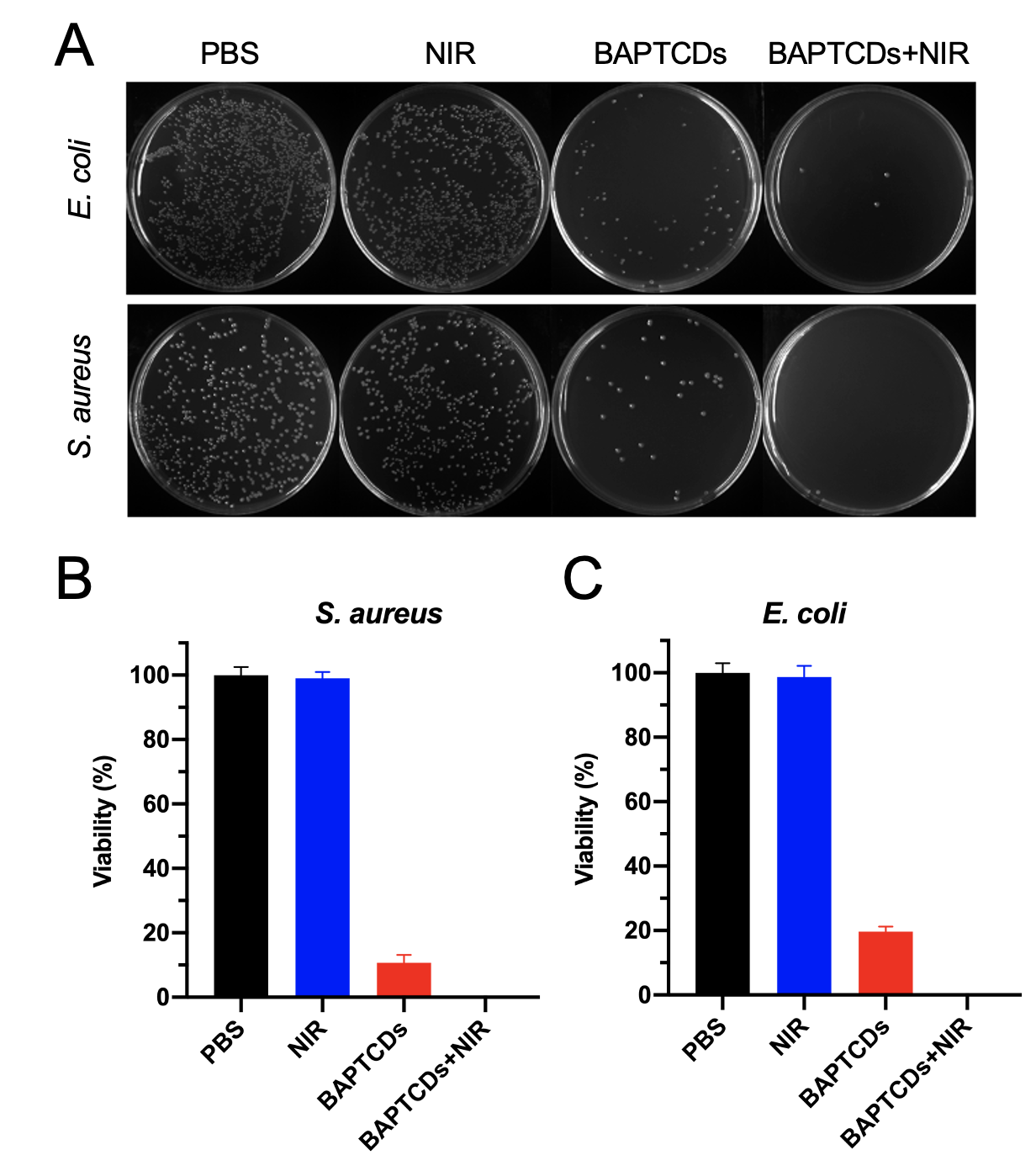
图3 BAPTCDs在不同环境中的存活数量变化(从左到右分别为大肠杆菌ATCC 700926和金黄色葡萄球菌ATCC 29213在PBS、近红外激光、BAPTCDs溶液和BAPTCDs与近红外共同作用下的结果。图A为标准平板法结果,图B和图C为菌落数据统计结果。)
相关科研成果以“Design, synthesis, and application of carbon dots with synergistic antibacterial activity”为题发表在Frontiers in Bioengineering and Biotechnology(影响因子5.82,JCR一区)上。郄兴旺博士为该论文第一作者,宋一之研究员和董文飞研究员为通讯作者。该研究得到了国家自然基金委、中科院科研仪器和江苏省自然科学基金等的共同资助。
论文链接: https://www.frontiersin.org/articles/10.3389/fbioe.2022.894100/full
 附件下载:
附件下载: